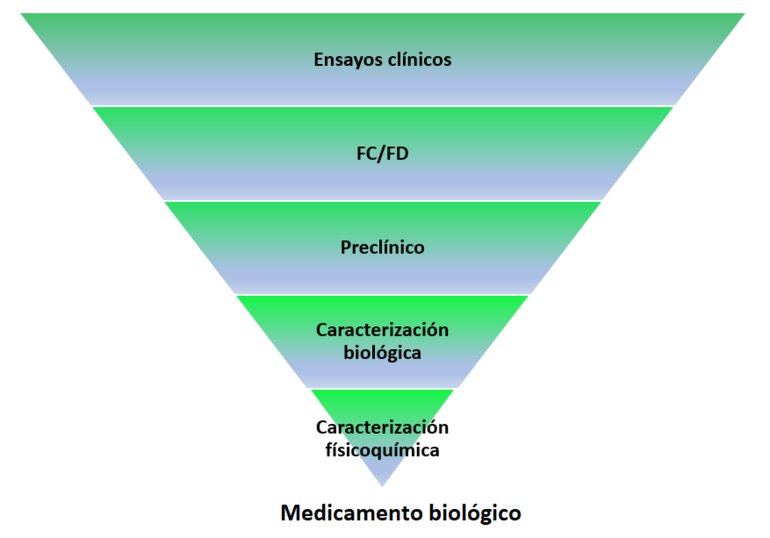
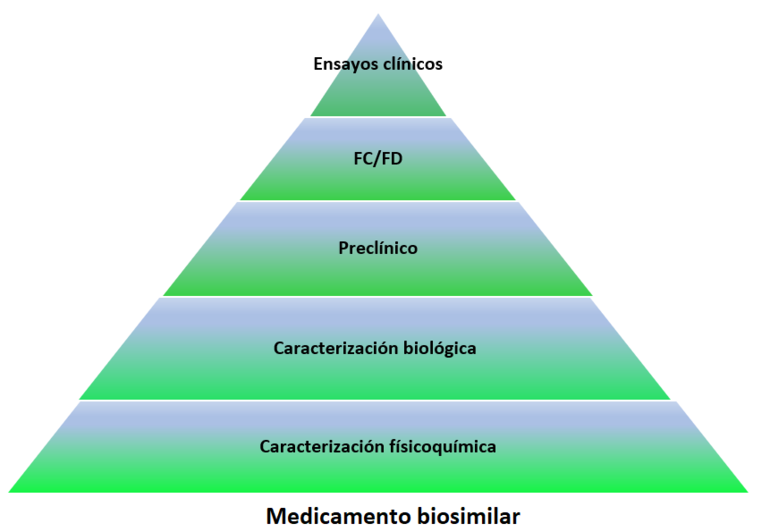
El desarrollo de medicamentos biosimilares presupone un cambio de paradigma al modelo tradicional utilizado con un medicamento innovador. Mientras que para una nueva entidad molecular la evidencia de su desarrollo se basa en generar datos que confirmen su seguridad y eficacia.
En el caso de los biosimilares, el objetivo principal es la demostración de similitud entre la estructura molecular, casi siempre proteica, del fármaco original y la del propuesto como biosimilar, ver Figura 1.
Figura 1: Requisitos de datos para la autorización de medicamento biológico frente biosimilar
En el desarrollo de medicamentos biosimilares se debe considerar:
- Que el biosimilar debe contener la misma estructura primaria (es decir, la secuencia de aminoácidos) y la misma estructura 3D (plegado de las proteínas) que el fármaco de referencia;
- Que se realiza una comparación, de forma exhaustiva y específica para cada producto, de propiedades funcionales, farmacocinética, farmacodinámica así como también eficacia clínica, seguridad e inmunogenicidad;
- Que para el producto terminado, tanto el medicamento biosimilar como el de referencia deben presentar la misma posología y vía de administración;
- Que se pueden permitir ciertas diferencias si éstas no afectan a la seguridad ni a la eficacia, por ejemplo, diferencias en la formulación del medicamento, por ejemplo, excipientes; en la presentación y en el sistema de administración, por ejemplo, tipo de dispositivo de inyección [1].
El estudio de comparabilidad se divide en etapas secuenciales bien establecidas y específicas para cada producto. En cada una de éstas se establecen criterios de aceptación para determinar el grado de similitud entre el biosimilar y el biológico tomado como referencia. Después de cada fase se evalúa si se puede continuar o, por el contrario, si resulta necesario exigir nuevos estudios pre-clínicos o clínicos. Si en algún paso aparecen diferencias consideradas sustanciales, o el ejercicio de comparación es incompleto, el medicamento no se puede considerar biosimilar.
Las etapas de comparabilidad incluyen:
- Comparabilidad analítica: Los estudios in vitro comparan la estructura proteica y la función biológica utilizando técnicas sensibles capaces de detectar diferencias mínimas con relevancia clínica.
- Comparabilidad preclínica: incluye estudios farmacodinámicos, principalmente in vitro, que analizan la unión y la activación (o inhibición) de las dianas fisiológicas y los efectos fisiológicos inmediatos en las células. Solo se requieren estudios toxicológicos in vivo en algunos casos muy concretos, por ejemplo, cuando el biosimilar es producido por un nuevo tipo de célula u organismo, o cuando la formulación incluye excipientes nuevos no empleados previamente
- Comparabilidad clínica: El objetivo de los estudios en humanos no es demostrar la seguridad y la eficacia en los pacientes, ya que estos parámetros ya han sido establecidos para el medicamento de referencia. Se utilizan ensayos clínicos comparados, que permiten confirmar que ambos productos contienen principios activos altamente similares y que su calidad, eficacia y seguridad son equivalentes. El número y tipo de ensayos clínicos requeridos depende de muchos factores. Entre otros destacan la complejidad de la molécula estudiada, los datos obtenidos de las fases previas del estudio de comparabilidad y la disponibilidad de marcadores clínicos validados que puedan correlacionarse con la eficacia [1].
Comentario del Editor
Lectores interesados en conocer más sobre requisitos de autorización de biosimilares están invitados a visitar www.gabi-journal.net para ver el siguiente manuscrito en GaBI Journal:
The EU regulatory network and emerging trends – a review of quality, safety and clinical development programmes
GaBI Journal está indexado en Embase, Scopus, Emerging Sources Citation Index y más.
Lectores interesados en contribuir con un artículo de investigación o perspectiva en español y/o inglés sobre biosimilares a GaBI Journal – una revista académica independiente, con revisión por pares – por favor envíe su manuscrito aquí.
Impacto de citación de GaBI Journal
1.9 - CiteScore 2020 (calculado el 5 de mayo de 2021)
1.9 - CiteScoreTracker 2021 (Última actualización el 4 de augusto de 2021)
Envíe un manuscrito a GaBI Journal
Artículos relacionados
Diferencias entre los medicamentos genéricos y los biosimilares
Posicionamiento sobre biológicos y biosimilares en Argentina
| Foro Latinoamericano Se ha lanzado la nueva sección del ‘Foro Latinoamericano’ sobre GaBI. El objetivo de esta nueva sección es brindarle las últimas noticias y actualizaciones sobre desarrollos de medicamentos genéricos y biosimilares en América Latina en español. Vea el artículo principal de esta semana: México presenta nuevo decreto sobre regulación sanitaria Explore las noticias en el Foro Latinoamericano! Regístrese para recibir el boletín informativo GaBI Latin American Forum. Informe a colegas y amigos sobre esta nueva iniciativa.
|
Referencia
1. Comisión Europea. Los biosimilares en la UE. Guía informativa para profesionales sanitarios.15/10/2018 [cited 2021 Aug 27]. Available from: https://www.ema.europa.eu/en/documents/leaflet/biosimilars-eu-information- guide-healthcare-professionals_es.pdf
Permiso otorgado para reproducir solo para uso personal y no comercial. Cualquier otra reproducción, copia o reimpresión de todo o parte de cualquier "Contenido" que se encuentre en este sitio web está estrictamente prohibida sin el consentimiento previo del editor. Póngase en contacto con el editor para obtener permiso antes de redistribuir.
Copyright: a menos que se indique lo contrario, todo el contenido de este sitio web es © 2021 Pro Pharma Communications International. Todos los derechos reservados.








 0
0










Post your comment