Argentina ha aprobado Agalzyme, un biosimilar de la agalsidasa beta, como la primera terapia de reemplazo enzimático para la enfermedad de Fabry en América Latina, lo que representa un importante avance en el acceso al tratamiento de este trastorno poco frecuente.
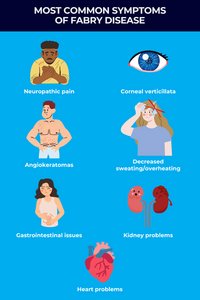
En un evento celebrado el 8 de agosto de 2025, el Laboratorio Biosidus anunció el lanzamiento de Agalzyme, un biosimilar de Fabrazyme (agalsidasa beta) de Sanofi, para el tratamiento de la enfermedad de Fabry. Este trastorno genético ligado al cromosoma X afecta el metabolismo de los glucosfingolípidos y presenta una prevalencia global estimada al nacimiento de aproximadamente 1 en 15.000, aunque se sospecha que la cifra real es mayor debido al subdiagnóstico.
También conocida como enfermedad de Anderson-Fabry, esta rara enfermedad de almacenamiento lisosomal se debe a variantes en el gen GLA, que codifica la enzima alfa-galactosidasa A (α-Gal A). La deficiencia en la actividad enzimática provoca la acumulación de globotriaosilceramida (GL-3) en las células, especialmente en riñones, corazón, sistema nervioso y vasos sanguíneos, lo que ocasiona un daño multisistémico progresivo.
La agalsidasa beta, principio activo tanto de Fabrazyme como de Agalzyme, es una terapia de reemplazo enzimático (ERT) que ayuda a degradar la GL-3 acumulada. Se administra por vía intravenosa y está indicada para pacientes adultos y pediátricos con enfermedad de Fabry.
Agalzyme es la primera ERT biosimilar para la enfermedad de Fabry aprobada y lanzada en Argentina y en América Latina. Desarrollada íntegramente a nivel local mediante tecnología de ADN recombinante, constituye una alternativa terapéutica segura, eficaz y más accesible. Se estima que entre 1.200 y 1.500 personas en Argentina padecen esta enfermedad, aunque solo unas 600 reciben tratamiento actualmente, en gran parte debido al retraso en el diagnóstico causado por síntomas inespecíficos y ser difícil de reconocer.
La aprobación por parte de la Agencia Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) de Argentina constituye un hito significativo para ampliar el acceso a terapias de alto costo destinadas a enfermedades raras en la región de América Latina, que enfrenta desafíos como barreras diagnósticas y limitaciones en los sistemas de salud.
A nivel global, Agalzyme se suma al precedente de agalsidasa beta BS (JR-051), el primer biosimilar de agalsidasa beta en el mundo, aprobado por el Ministerio de Salud, Trabajo y Bienestar de Japón en septiembre de 2018 [1] y lanzado posteriormente en noviembre de ese mismo año. JR-051 fue desarrollado por JCR Pharmaceuticals en colaboración con Amicus Therapeutics y GlaxoSmithKline.
La aprobación del biosimilar Agalzyme se sustentó en datos preclínicos y en el ensayo clínico de Fase III SMILE, que cumplió su criterio de valoración principal a las 26 semanas y demostró equivalencia terapéutica con el producto de referencia en términos de eficacia y seguridad. El estudio se llevó a cabo en centros de Buenos Aires, Córdoba y La Rioja. Expertos clínicos, entre ellos el Dr. Politei, la Dra. Perretta, el Dr. Cabrera y el Dr. Nieto, han destacado el potencial de esta terapia para mejorar la calidad de vida de los pacientes y ampliar el acceso al tratamiento.
En febrero de 2024, mAbxience firmó un acuerdo clave de fabricación con Biosidus para respaldar la producción [2].
La autorización representa un avance significativo en la capacidad de Argentina para desarrollar tratamientos para enfermedades raras y contribuye a reducir las barreras económicas de acceso a la atención. Biosidus planea expandir la distribución a otros mercados emergentes y, eventualmente, buscar la aprobación regulatoria en Europa y Estados Unidos.
Artículos relacionados
Los pacientes latinoamericanos se enfrentan a una espera de 4,7 años para obtener tratamientos innovadores
EMA recommends approval of four bevacizumab biosimilars
Comentarios del editor
Los requisitos reglamentarios de la Agencia Europea de Medicamentos garantizan los mismos criterios de exigencia máxima de calidad, seguridad y eficacia para medicamentos biosimilares que para los biológicos innovadores, y también incluyen un estudio riguroso de comparabilidad con el producto de referencia pero no están universalmente aceptados por la agencias regulatorias fuera de la Unión Europea (UE). Cabe señalar que los ‘biosimilares’ aprobados en Argentina podrían no haber sido autorizados si hubieran sido sometidos a los estrictos procesos regulatorios requeridos para la aprobación de biosimilares en la UE.
Referencia
1. GaBI Online - Generics and Biosimilars Initiative. Biosimilars approved in Japan [www.gabionline.net]. Mol, Belgium: Pro Pharma Communications International; [cited 2025 Sep 17]. Available from: www.gabionline.net/Biosimilars/General/Biosimilars-approved-in-Japan
2. GaBI Online - Generics and Biosimilars Initiative. mAbxience y Biosidus firman un acuerdo para fabricar Agalsidasa Beta [www.gabionline.net]. Mol, Belgium: Pro Pharma Communications International; [cited 2025 Sep 17]. Available from: www.gabionline.net/es/noticias-farmaceuticas/mabxience-y-biosidus-firman-un-acuerdo-para-fabricar-agalsidasa-beta
Permiso otorgado para reproducir solo para uso personal y no comercial. Cualquier otra reproducción, copia o reimpresión de todo o parte de cualquier 'Contenido' que se encuentre en este sitio web está estrictamente prohibida sin el consentimiento previo del editor. Póngase en contacto con el editor para obtener permiso antes de redistribuir.
Copyright – a menos que se indique lo contrario, todo el contenido de este sitio web es © 2025 Pro Pharma Communications International. Todos los derechos reservados.








 0
0









Post your comment