En su revisión, Machado et al. examinan la transparencia y las directrices reglamentarias relativas a la concesión de licencias de biosimilares, así como el recuento de biosimilares que han recibido la aprobación de 13 autoridades reguladoras de medicamentos [1].
En este artículo se analiza el primer biosimilar que recibió la aprobación tras la publicación de las directrices de autorización por parte de las autoridades reguladoras de todo el mundo
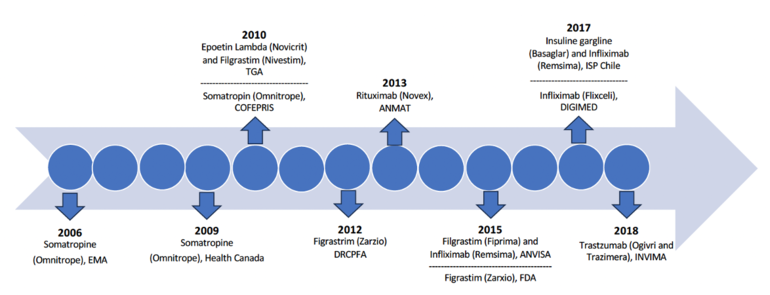
En 2006, la Agencia Europea de Medicamentos se convirtió en la autoridad reguladora pionera en autorizar un biosimilar: la hormona de crecimiento humano somatropina de Sandoz, una referencia a Omnitrope. Health Canada y COFEPRIS siguieron su ejemplo en 2009 y 2010, respectivamente, aprobando el mismo producto, aunque en México se denominó biocomparable en ese momento. Las aprobaciones subsecuentes de los primeros biosimilares por parte de la TGA de Australia y la Food and Drug Administration (FDA) de Estados Unidos ocurrieron en 2010 y 2015, como se muestra en la Figura 1.
La Tabla 1 presenta datos de los primeros biológicos de continuación aprobados en siete países latinoamericanos.
| Table 1: Primer biológico de continuación aprobado tras la publicación de las directrices de concesión de licencia en América Latina
|
| Ano
|
Autoridad reguladora (país)
|
Denominación común (marca)
|
Fabricante
|
| 2010
|
COFEPRIS (México)
|
Somatropin (Omnitrope)
|
Sandoz
|
| 2012
|
DRCPFA (Guatemala)
|
Filgrastim (Zarzio)
|
Sandoz
|
| 2013
|
ANMAT (Argentina)
|
Rituximab (Novex)
|
Elea Phoenix
|
| 2015
|
ANVISA (Brazil)
|
Filgrastim (Fiprima)
Infliximab (Remsina)
|
Eurofarma Laboratório
Celltrion
|
| 2017
|
ISP (Chile)
|
Infliximab (Remsina)
Insulin gargline (Basaglar)
|
Laboratorios Saval
Eli Lilly
|
| 2017
|
DIGEMID (Perú)
|
Infliximab (Flixceli)
|
Celltrion
|
| 2018
|
INVIMA (Colombia)
|
Trastuzumab (Ogivri)
Trastuzumab (Trazimera)
|
Mylan GmbH
Pfizer
|
Desde entonces, los biológicos de continuación adicionales han sido aprobados por las respectivas autoridades reguladoras en América Latina, en particular ANVISA de Brasil a pesar de que COFEPRIS de México es la primera autoridad reguladora en aprobar un biocomparable.
A mediados de mayo de 2023, ANVISA había aprobado 52 productos biológicos/biosimilares de continuación dentro de las clases de: 1) hormona de crecimiento humano; 2) factor estimulante de colonias de granulocitos; 3) insulina; 4) inhibidor del factor de necrosis tumoral (TNF); y 5) anticuerpo monoclonal para su uso en Brasil [2].
La inversión en biosimilares en los países latinoamericanos aumenta año tras año y las autoridades reguladoras de muchos países latinoamericanos se han rediseñado y estandarizado para la aprobación de biosimilares. Sin embargo, las regulaciones locales varían de un país a otro [3].
Artículos relacionados
Study of the use of generic and biosimilar drugs in Latin America
Recommendations to address challenges to biosimilars in Latin America
Similar biotherapeutic products approved and marketed in Latin America
| FORO LATINOAMERICANO Se ha lanzado la nueva sección del ‘Foro Latinoamericano’ sobre GaBI. El objetivo de esta nueva sección es brindarle las últimas noticias y actualizaciones sobre desarrollos de medicamentos genéricos y biosimilares en América Latina en español. Ver el último artículo de cabecera: Consulta pública para la modificación de la regulación de biosimilares !Explore las noticias en el Foro Latinoamericano! Regístrese para recibir el boletín informativo GaBI Foro Latinoamericano. Informe a colegas y amigos sobre esta nueva iniciativa.
|
Referencias
1. Machado FLDS, Cañás M, Doubova SV, Urtasun MA, Marín GH, Osorio-de-Castro CGS, et al. Biosimilars approvals by thirteen regulatory authorities: A cross-national comparison. Regul Toxicol Pharmacol. 2023 Sep 1;144:105485. doi:10.1016/j.yrtph.2023.105485.
2. Cestari de Oliveira SH. Follow-on biologicals/biosimilars approved in Brazil: May 2023 update. Generics and Biosimilars Initiative Journal (GaBI Journal). 2023;12(2):67-72. doi:10.5639/gabij.2023.1202.012
3. Ortiz-Prado et al. Biotechnological therapies and biosimilars for COVID-19: scarcities, poor regulation, and pharmaceutical black market: a case analysis in Ecuador. Generics and Biosimilars Initiative Journal (GaBI Journal). 2021;10(4):184-92. doi:10.5639/gabij.2021.1004.023
Permiso otorgado para reproducir solo para uso personal y no comercial. Cualquier otra reproducción, copia o reimpresión de todo o parte de cualquier 'Contenido' que se encuentre en este sitio web está estrictamente prohibida sin el consentimiento previo del editor. Póngase en contacto con el editor para obtener permiso antes de redistribuir.
Copyright – a menos que se indique lo contrario, todo el contenido de este sitio web es © 2024 Pro Pharma Communications International. Todos los derechos reservados.








 0
0









Post your comment