En noviembre de 2024, en el American College of Rheumatology (ACR) Convergence 2024, Alvotech compartió los resultados positivos del criterio de valoración principal de su estudio comparable de seguridad y eficacia para su biosimilar propuesto de golimumab, AVT05 [1]. Se trata de un candidato a biosimilar del antiinflamatorio Simponi de Janssen Biotech.
Esto se produce tras las noticias de abril y junio de 2024 sobre el prometedor resultado de primera línea del estudio clínico farmacocinético (AVT05-GL-P01, NCT05632211;) para AVT05 [2].
El golimumab es un anticuerpo monoclonal (mAb) IgG1қ humano recombinante que presenta múltiples glicoformas. Bloquea la unión del factor de necrosis tumoral alfa (TNF-α) a sus receptores, reduciendo así la inflamación mediada por el TNF-α. El golimumab está aprobado para el tratamiento de enfermedades inflamatorias como la artritis reumatoide, la artritis psoriásica y la espondilitis anquilosante.
En este último estudio, Alvotech evaluó la eficacia comparable de AVT05 y el producto de referencia (PR) en un estudio confirmatorio de eficacia y seguridad (NCT05842213) en pacientes con AR de moderada a grave. Llevaron a cabo un estudio aleatorizado, doble ciego, de 2 brazos, de grupos paralelos y de control activo. Se aleatorizó a 502 participantes (1:1), que recibieron AVT05 (n = 251) o el producto de referencia (n = 251), 50 mg por vía subcutánea cada 4 semanas hasta la semana 12 inclusive. La aleatorización se estratificó en función de la puntuación basal de la actividad de la enfermedad-28 para la AR mediante la proteína C reactiva (DAS28-CRP) (≤5,1 y >5,1). El criterio de valoración primario fue el cambio con respecto al valor basal en la DAS28-PCR en la semana 16.
En la presentación del póster se expusieron las principales conclusiones del estudio.
1.Eficacia (semana 16):
- La diferencia media por mínimos cuadrados entre AVT05 y el producto de referencia se situó dentro del margen de equivalencia preespecificado (-0,6 a 0,54), lo que demuestra la eficacia comparativa.
- Los análisis de sensibilidad confirmaron la solidez de las estimaciones del objetivo primario.
- Los análisis de subgrupos no mostraron diferencias notables.
2.Seguridad:
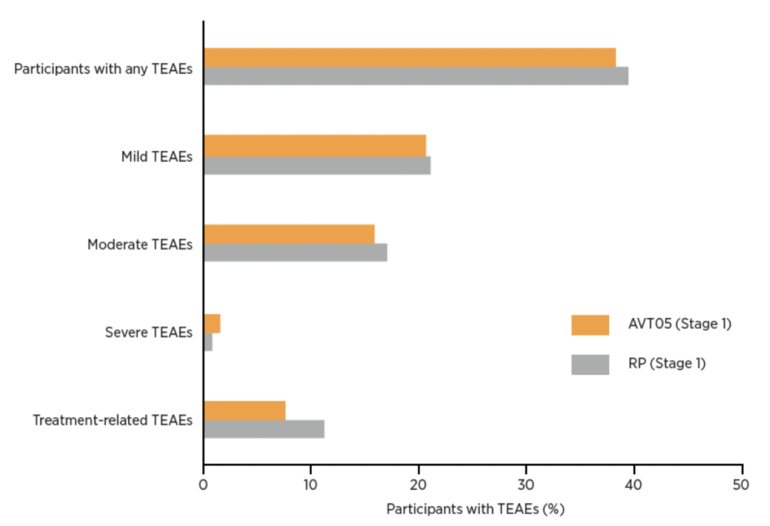
- Hasta la semana 16, los acontecimientos adversos emergentes del tratamiento (AETT) fueron similares entre los grupos (38,2% para AVT05 frente a 39,4% para RP), Figura 1. La mayoría de los AETT fueron leves. La mayoría de los AET fueron leves.
- Se produjeron EAET graves en 4 participantes de AVT05 y 2 participantes del producto de referencia, con 1 caso en cada grupo considerado relacionado con el tratamiento, lo que condujo a la interrupción del estudio.
Figura 1: Resumen de los EAET notificados hasta la semana 16
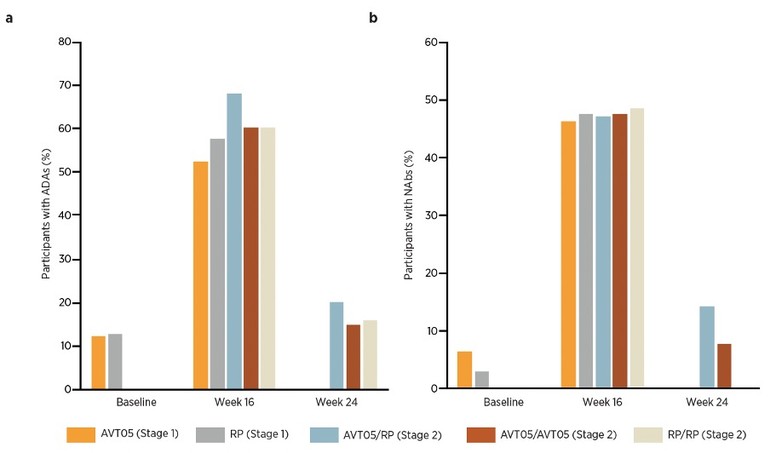
3. Inmunogenicidad (ver Figura 2):
- En la semana 16, las tasas de anticuerpos antifármaco (ADA) fueron similares (52,7% en AVT05 y 57,8% en los grupos de referencia), al igual que las tasas de anticuerpos neutralizantes (nAbs) (46,6% frente a 47,6%).
Figura 2: Incidencia de anticuerpos positivos en las fases 1 y 2: a) ADA; b) NAbs (conjunto de análisis de seguridad)
4. Resultados posteriores al cambio (semana 24):
- No se observaron diferencias significativas en la seguridad o la inmunogenicidad, incluso entre los participantes que cambiaron de la referencia a AVT05.
En el momento de la presentación, el estudio estaba incompleto y continuará hasta la semana 52 para seguir evaluando los resultados a largo plazo.
En general, se concluyó que el análisis del cambio en DAS28-CRP desde el inicio hasta la semana 16 apoya la evaluación de la eficacia comparativa entre AVT05 y el producto de referencia. Además, el biosimilar presentó un perfil de seguridad e inmunogenicidad similar al observado para el producto de referencia hasta la semana 16, que persistió hasta la semana 24.
Alvotech fue la primera empresa en presentar datos clínicos de un biosimilar propuesto para Simponi. El 4 de noviembre de 2024, la Agencia Europea de Medicamentos aceptó su solicitud de autorización de comercialización para AVT05. El 10 de octubre de 2024, la Agencia aceptó la solicitud de comercialización de AVT03, una propuesta de biosimilar de Prolia y Xgeva (denosumab).
Los biosimilares de adalimumab (AVT02) y ustekinumab (AVT04) de Alvotech fueron aprobados y/o lanzados en 2024, con seis candidatos biosimilares adicionales actualmente en desarrollo, incluido AVT05 [2].
Artículos relacionados
Los datos a largo plazo respaldan la comparabilidad clínica de AVT04 con Stelara
Clinical study advances for Alvotech golimumab and Dr Reddy’s rituximab biosimilars
Referencias
1. Assessment of Comparative Efficacy Between Candidate Biosimilar AVT05 and Reference Golimumab
https://acrabstracts.org/abstract/assessment-of-comparative-efficacy-between-candidate-biosimilar-avt05-and-reference-golimumab/
2. GaBI Online - Generics and Biosimilars Initiative. Topline results from clinical development programme for candidate biosimilar AVT05 golimumab [www.gabionline.net]. Mol, Belgium: Pro Pharma Communications International; [cited 2025 Jan 28]. Available from: www.gabionline.net/biosimilars/research/topline-results-from-clinical-development-programme-for-candidate-biosimilar-avt05-golimumab
Permiso otorgado para reproducir solo para uso personal y no comercial. Cualquier otra reproducción, copia o reimpresión de todo o parte de cualquier 'Contenido' que se encuentre en este sitio web está estrictamente prohibida sin el consentimiento previo del editor. Póngase en contacto con el editor para obtener permiso antes de redistribuir.
Copyright – a menos que se indique lo contrario, todo el contenido de este sitio web es © 2025 Pro Pharma Communications International. Todos los derechos reservados.








 0
0











Post your comment